
„Erstaunliche, vielschichtige und kuriose Erlebnisse aus der Welt pharmazeutischer Audits“
Diesen April ist ein neues Buch von Heinrich Prinz erschienen, bei dem u.a. Karl Metzger, Geschäftsführer der gmPlan GmbH, ebenfalls seine Erfahrungen teilt. Wie der Name schon vermuten lässt, befasst sich das Werk mit den Erlebnissen und Eindrücken, die Auditoren im Zuge von Audits, die in den unterschiedlichsten Regionen des Globus stattfanden, gewonnen haben.
Ein Auszug aus dem Klapptext: Ist mein Medikament sicher? Kann ich dieser Tablette vertrauen? Die einzelnen Bestandteile unserer Medikamente kommen aus der ganzen Welt. Das heimische Unternehmen muss die einwandfreie Qualität seiner Produkte garantieren. Daher schicken die Pharmaunternehmen Kontrolleure zu den einzelnen Herstellern in jeden Winkel der Welt, um sich die Produktion vor Ort anzuschauen. Diesen Vorgang nennen die Unternehmen Audits, die von speziell qualifizierten Auditoren durchgeführt werden…


 EN
EN
 Verstärkung im GMP Umfeld
Verstärkung im GMP Umfeld
 Fachliche Voraussetzungen für den BTM-Verantwortlichen
Fachliche Voraussetzungen für den BTM-Verantwortlichen Voraussetzungen und Inhalte der Tätigkeit als Verantwortlichen Person
Voraussetzungen und Inhalte der Tätigkeit als Verantwortlichen Person Wir begleiten Sie auf dem Weg zur GDP Zertifizierung
Wir begleiten Sie auf dem Weg zur GDP Zertifizierung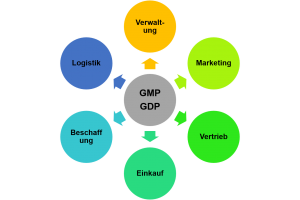 Grundsätzliches zu Regeln und Begrifflichkeiten
Grundsätzliches zu Regeln und Begrifflichkeiten Die Ausnahme erstreckt sich auf die Herstellung (in der EU) von Stoffen in Arzneimitteln sowie von Wirkstoffen, die exportiert werden und sich im Geltungsbereich der Rechtsvorschriften der Gemeinschaft für Arzneimittel befinden. Die Ausnahme gilt ebenfalls für Importe von Stoffen sowie Wirkstoffen in Arzneimitteln. Für die Praxis heißt das: Jeder Hersteller oder Importeur ist verpflichtet, sicherzustellen, dass sein Produkt ausschließlich in Arzneimitteln eingesetzt wird. Wird also beispielsweise Vaseline in einer Arzneisalbe vermischt, ist es von REACH ausgenommen. Landet das Erdöldestillat ebenfalls in einer kosmetischen Creme, heißt es registrieren.
Die Ausnahme erstreckt sich auf die Herstellung (in der EU) von Stoffen in Arzneimitteln sowie von Wirkstoffen, die exportiert werden und sich im Geltungsbereich der Rechtsvorschriften der Gemeinschaft für Arzneimittel befinden. Die Ausnahme gilt ebenfalls für Importe von Stoffen sowie Wirkstoffen in Arzneimitteln. Für die Praxis heißt das: Jeder Hersteller oder Importeur ist verpflichtet, sicherzustellen, dass sein Produkt ausschließlich in Arzneimitteln eingesetzt wird. Wird also beispielsweise Vaseline in einer Arzneisalbe vermischt, ist es von REACH ausgenommen. Landet das Erdöldestillat ebenfalls in einer kosmetischen Creme, heißt es registrieren. Artikel 95 – Faire Bedingungen für alle?
Artikel 95 – Faire Bedingungen für alle?